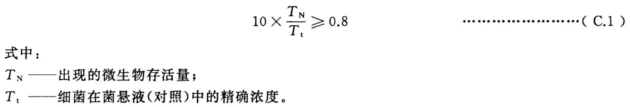|
|
资料
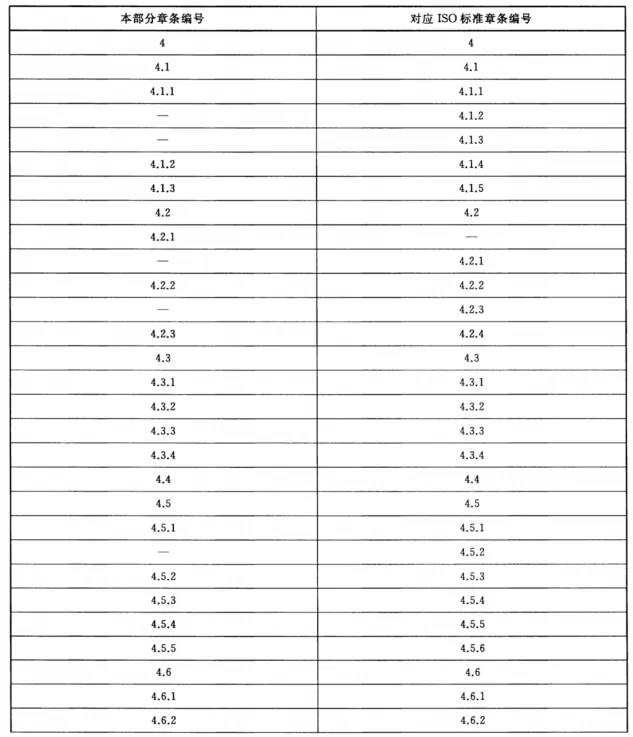
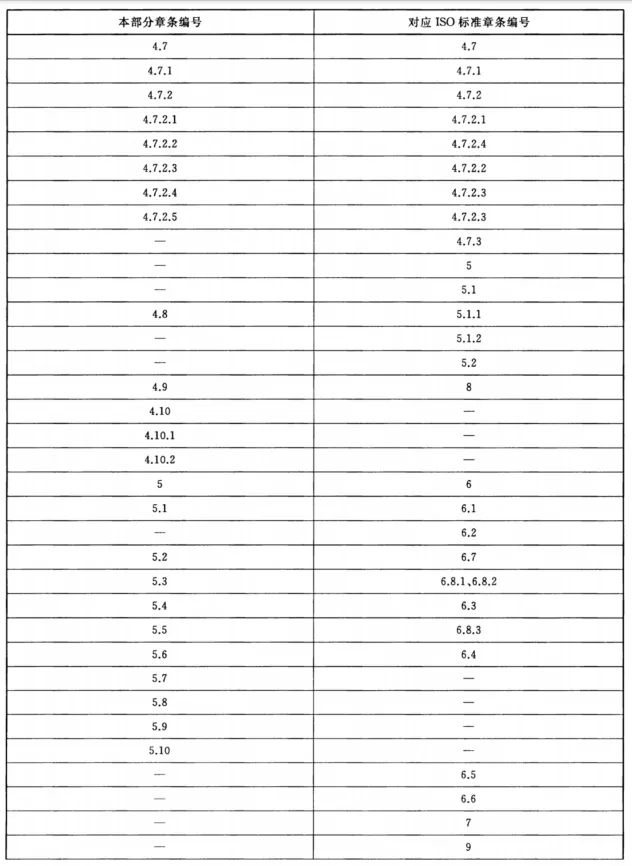
行业标准 | 清洗消毒器 第5部分:对不耐高温的非介入式医疗器械进行化学消毒的清洗消毒器 要求和试验 YY/T 0734.5发表时间:2024-04-25 09:02  YY/T 0734.5-2020 中华人民共和国医药行业标准  清洗消毒器 第5部分:对不耐高温的非介入式医疗器械 进行化学消毒的清洗消毒器 要求和试验 Washer-disinfectors-Part 5:Requirements and tests for washer-disinfectors employing chemical disinfection for non-invasive, noncritical thermolabile medical devices (ISO 15883-7:2016,Washer-disinfectors-Part 7:Requirements and tests for washerdisinfectors employing chemical disinfection for non-invasive, noncritical thermolabile medical devices and healthcare equipment,MOD) 目 次 前言 1 范围 2 规范性引用文件 3 术语和定义 4 要求 5 试验方法 附录A (资料性附录) 本部分与ISO 15883-7:2016的相比的结构变化情况 附录B (资料性附录) 本部分与ISO 15883-7:2016的技术差异及其原因 附录C (规范性附录) 液体输送系统消毒的微生物验证方法 附录D (规范性附录) 负载化学消毒效果微生物检验所使用的指示物的制备与评价 附录E (资料性附录) 生物指示物的测试位置示例 附录F (规范性附录) 消毒后漂洗水微生物污染试验 前 言 YY/T 0734《清洗消毒器》分为以下5个部分: ——第1部分:通用要求和试验; ——第2部分:对外科和麻醉器械等进行湿热消毒的清洗消毒器要求和试验; 一一第3部分:对人体废弃物容器进行湿热消毒的清洗消毒器要求和试验; ——第4部分:对非介入式等医疗器械进行湿热消毒的清洗消毒器要求和试验; 一一第5部分:对不耐高温的非介入式医疗器械进行化学消毒的清洗消毒器要求和试验。 本部分为YY/T 0734 的第5部分。 本部分按照GB/T1.1-2009给出的规则起草。 本部分使用重新起草法修改采用ISO 15883-7:2016《对非介入性、非关键、不耐高温医疗器械和保健设备采用化学消毒的清洗消毒器的要求和测试》。 本部分与ISO 15883-7:2016相比在结构上有较多调整,附录A中列出了本部分与ISO 15883-7:2016的章条编号对照一览表。 本部分与ISO 15883-7:2016相比存在技术差异,这些差异涉及的条款已通过在其外侧页边空白位置的垂直单线(|)进行了标示,附录B中给出了相应技术差异及其原因一览表。 本部分还做了下列编辑性修改: ——修改了标准名称; ——删除了 ISO 15883-7:2016的附录A。 请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别这些专利的责任。 本部分由国家药品监督管理局提出。 本部分由全国消毒技术与设备标准化技术委员会(SAC/TC200)归口。 本部分起草单位:山东新华医疗器械股份有限公司、广东省医疗器械质量监督检验所、山东威高集团医用高分子制品股份有限公司。 本部分主要起草人:陈琨、邢立镛、孙名强、洪梓祥、王毅。 清洗消毒器 第5部分:对不耐高温的非介入式医疗器械进行 化学消毒的清洗消毒器 要求和试验 1 范围 YY/T 0734的本部分规定了对不耐高温的非介入式医疗器械进行化学消毒的清洗消毒器的特殊要求及其试验方法。 注:这些医疗器械通常为低风险医疗器械,如病床、手术台、轮椅等。 本部分要求与YY/T0734.1-2018中规定的通用要求合并使用。 本部分要求的清洗消毒器适用于对非介人、不耐高温的可重复使用医疗器械,在一个周期内进行清洁和化学消毒的清洗消毒器的特殊要求,包括清洁和消毒的性能要求,以及有可能会用到元器件和附件的要求。 本部分的要求不适用于YY/T 0734.2、YY/T 0734.3、YY/T 0734.4和GB/T 35267 范围中定义的清洗消毒器。 2 规范性引用文件 下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。 GB4793.1 测量、控制和实验室用电气设备的安全要求第1部分:通用要求(GB4793.1-2007,IEC 61010-1:2001,IDT) GB/T 18268.1 测量、控制和实验室用的电设备电磁兼容性要求第1部分:通用要求(GB/T 18268.1-2010,IEC 61326-1:2005,IDT) GB/T 19973.1 医疗器械的灭菌微生物学方法第1部分:产品上微生物总数的测定(GB/T 19973.1-2015,ISO 11737-1:2006,IDT) GB/T 35267 内镜清洗消毒器(GB/T 35267-2017,ISO 15883-4:2008,NEQ) YY/T 0734.1-2018 清洗消毒器第1部分;通用要求和试验(ISO15883-1:2006+AMD 1:2014,MOD) YY/T 0734.4 清洗消毒器第4部分:对非介入式等医疗器械进行湿热消毒的清洗消毒器要求和试验(YY/T0734.4-2016,ISO15883-6:2011,NEQ) 3 术语和定义 3.1 化学消毒 chemical disinfection 4 要求 4.1 概述 4.1.1 清洗消毒器应符合YY/T0734.1-2018的要求,其中4.5.1(湿热消毒)、4.16[处理过程温度控制,不包括d)和e)]、4.17(过程验证)不适用。 4.1.2 化学剂剂量的控制(见YY/T0734.1-2018中4.14.4和4.14.5)可以借助钥匙、密码、工具等进行设置。计量系统的准确性应至少控制在±10%范围内。 4.1.3 自动控制器应确保消毒剂的配比浓度在指定的限制范围内。 4.2 清洁 4.2.1 清洗阶段后目测,负载上应无明显的可见污染物。 4.2.2 清洗阶段 4.2.3 若清洗消毒器被设计成允许清洗剂重复使用连续两个或两个以上的运行周期,应确保清洁溶液的有效性和安全性(如异物积累、器械兼容性)。至少包括以下内容: 4.3 消毒 4.3.1 应有化学消毒阶段,也可与清洁阶段合并,应有消毒效果。 4.3.2 本部分要求的消毒剂是使用状态为液体的消毒剂(也可以使用气体消毒剂,但需要进行等效性试验),应符合以下要求: 4.3.3 应监测消毒阶段的消毒剂温度在指定的范围内,且应在器械的耐受温度范围内。 4.3.4 若清洗消毒器被设计成允许消毒剂重复使用连续两个或两个以上的运行周期,应确保消毒溶液的有效性和安全性(如异物积累、器械兼容性)。至少包括以下内容: 4.4 漂洗用水 4.5 自身消毒 4.5.1 应有自身消毒周期以确保清洗消毒器不会成为负载的污染源,并提供一种在设备维护、修理或检测之后进行消毒的方法。 4.5.2 自身消毒周期应: 4.5.3 自身消毒周期应确保水处理装置故障造成的污染可以得到有效消毒。 4.5.4 应通过温度传感器放置于最低温度点的测温系统来评估热消毒系统。整个系统进行湿热消毒时应达到规定的消毒温度。 4.5.5 对于化学自身消毒周期应进行微生物检测。如果清洗消毒器提供自身消毒的能力通过了附录C测试,则应被视为合格。 4.6 干燥 4.6.1 应能对负载进行干燥。 4.6.2 程序结束时有少量可见水也视为合格。 4.7 水处理装置 4.7.1 概述 4.7.2 水处理装置的消毒 4.7.2.1 如果水处理装置是清洗消毒器的一部分,水处理装置应能实现定期消毒。最低消毒频率应根据买方提供的水源质量和水处理装置产水中细菌含量来确定。 4.7.2.2 如果水处理装置是清洗消毒器的一部分,从漂洗阶段开始到程序结束,视情况而定,终末漂洗用水处理系统应完全满足4.4要求,并能被清洗消毒器自动控制器监控以保证水处理系统在预定的工作参数内工作。 4.7.2.3 如果水处理装置不是清洗消毒器的一部分,则提供清洗消毒器的供水要求,包含水源对于微生物污染的指标要求[见4.9j)]. 4.7.2.4 若适用,与经过无菌处理的水源之间的用于漂洗的连接管道应能实现无菌输送。 4.7.2.5 若适用,应按规定消毒的频率及方法对连接管道进行定期消毒。 4.8 设计 清洗消毒器应设计成无须进入腔体内即可装卸载负载。 4.9 制造商应提供的信息 4.10 安全 4.10.1 清洗消毒器应符合GB4793.1的要求。 4.10.2 清洗消毒器应符合GB/T 18268.1的要求。 5 试验方法 5.1 概述 5.1.1 按照 YY/T0734.1-2018中规定的相应试验方法进行试验,并检查制造商提供的随机文件,实际操作验证。 5.1.2 按照YY/T 0734.1-2018中5.14的方法试验。 5.1.3 空载运行清洗消毒器,自动配制消毒剂制造商规定的浓度,排出溶液,在排水口取样,按照消毒剂制造商规定的方法检测浓度。 5.2 清洁试验 5.2.1 按YY/T0734.1-2018中B.1的方法制作试验污染物,按照本部分附录D.4.3方法以及附录E所示布点进行目测。 5.2.2 查验清洗阶段的清洗消毒器的温度显示。 5.2.3 查验清洗剂的使用说明书,并运行设备检查。 5.3 消毒试验 5.3.1 运行清洗消毒器,检查化学消毒阶段,按照附录D的方法试验,规定负载可参考附录E。 5.3.2 检查使用的消毒剂标准或文件,并在消毒剂的最短消毒时间、最低作用浓度、最低温度下,按照附录D、附录E的方法,进行消毒效果试验。当清洁消毒同时进行时,应选择有机干扰物进行消毒效果试验,可选择浓度为3.0%牛血清白蛋白作为有机干扰物,或选择其他有代表性的临床污染物。 5.3.3 在消毒阶段的消毒温度试验应按YY/T0734.1-2018中5.16.2规定的方法布置温度传感器并进行记录,检查试验中记录的温度值。若产品不使用负载架,将相关要求由负载架改为处理物品作为参照。 5.3.4 按照以下方法进行试验: 5.4 漂洗用水试验 5.5 自身消毒试验 5.5.1 运行清洗消毒器的自身消毒周期,若使用湿热消毒,按照YY/T0734.1-2018中5.16的方法试验;当不使用湿热消毒时,按照附录C和附录F的方法试验。 5.5.2 运行清洗消毒器的自身消毒周期,查验运行状况、周期选择。 5.5.3 按照5.5.1的方法试验。 5.5.4 将温度传感器放置于制造商说明书声明的最低温度点检测。 5.5.5 对于化学自身消毒周期应进行微生物检测按照附录C的方法试验。 5.6 干燥试验 5.7 水处理装置试验 5.7.1 概述 5.7.2 水处理装置的消毒试验 5.7.2.1 查验清洗消毒器的定期消毒设置,并查验使用说明书。使用两个容量为150mL的无菌采样瓶接取消毒后的水处理装置的排水各100mL,按照GB/T 19973.1的方法进行微生物检验。 5.7.2.2 查验清洗消毒器显示的水处理装置的参数;使用两个容量为150mL的无菌采样瓶接取消毒后的水处理装置的排水各100mL,按照GB/T 19973.1的方法进行微生物检验。 5.8 设计试验 5.9 制造商应提供的信息试验 5.10 安全试验 5.10.1 按照GB4793.1规定的方法进行。 5.10.2 按照GB/T 18268.1规定的方法进行。 附录 A (资料性附录) 本部分与ISO 15883-7:2016的相比的结构变化情况 表A.1给出了本部分与ISO 15883-7:2016的章条编号对照情况。 表A.1本部分与ISO 15883-7:2016的章条编号对照情况
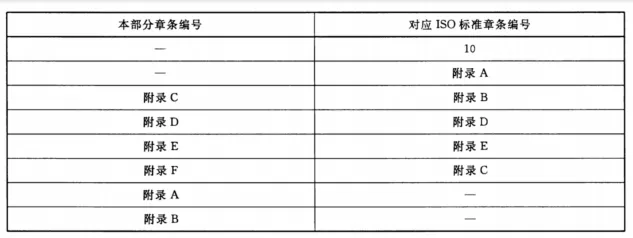
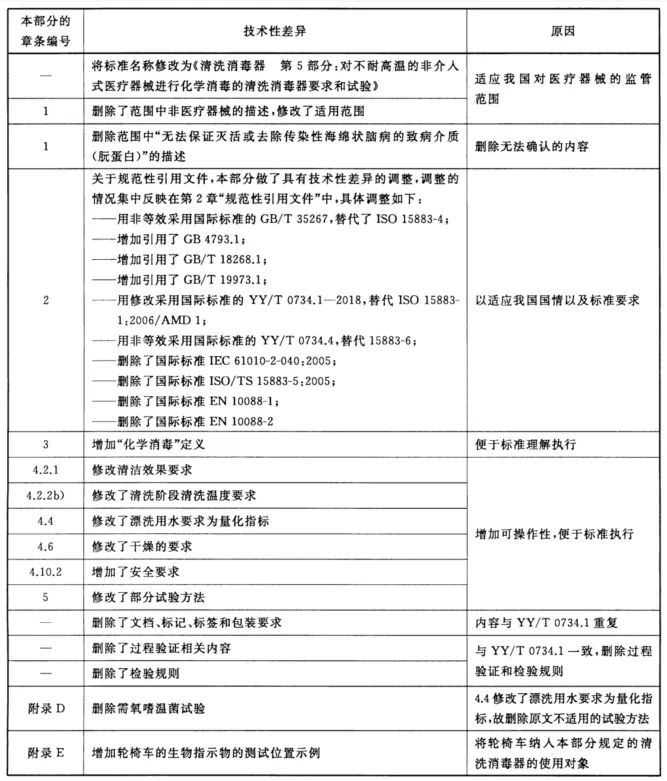
附录 B (资料性附录) 本部分与ISO 15883-7:2016的技术差异及其原因 表B.1给出了本部分与ISO 15883-7:2016的技术性差异及其原因。
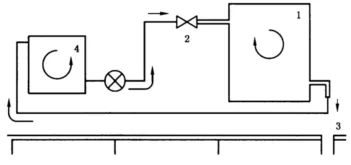
附录 C (规范性附录) 液体输送系统消毒的微生物验证方法 C.1 总则 C.2 试验用品 试验用品包括: ——清洗消毒器; ——试验徽生物:铜绿假单胞菌(ATCC15442)或等同抗力的微生物; ——菌悬液:1.0X10九次方CFU/mL; ——培养基:胰蛋白胨大豆琼脂(TSA)。 C.3 周期 C.3.1 概述 应使用以下周期: ——清洗消毒周期; ——自身消毒周期; ——采样周期; ——模拟污染周期。 C.3.2 采样周期 采样周期应与消毒前中断的常规清洗和消毒周期相适应,并用无菌蒸馏水代替洗涤剂。 一旦周期中断,应在水箱底部的工作管路中取样。 注:采样程序仅包括清洁和冲洗阶段以及水在工作管路中循环,不包括添加任意消毒剂或清洗剂。 如果消毒阶段前无法中断周期,那么应使用无菌纯化水(如反渗透水)替代所有进程中的化学溶液。 C.3.3 模拟污染周期 此规定程序对应以下的一个常规清洁和消毒周期: ——消毒溶液加热系统(若安装)停用,同时 ——使用无菌蒸馏水代替清洗剂和消毒剂。 在污染循环过程中,清洗消毒器连接到含有污染溶液的外部水箱(见图C.1),因此在污染循环的每个阶段,清洗消毒器只使用外部水箱的污染溶液。 C.4 外部水箱的连接 按图C.1所示安装外部水箱。
说明: 1——WD; 2——供水; 3——排水; 4——外部水箱。 注:按照制造商的建议,外部设备可以接入水网和清洗消毒器(如软水器等). C.5 程序 C.5.1 概述 C.5.1.1 外部水箱消毒 在每次测试之前,将制备污染溶液的外部容器置于A。值不低于600的热消毒循环中。 C.5.1.2 消毒后外部水箱中无微生物残留的验证 外部水箱的最后漂洗阶段期间,在外部水箱和连接管路里收集9mL循环水。 将1mL的10³CFU/mL的铜绿假单胞菌(ATCC15442)的细菌悬浮液加入之前取样的9mL水中。 充分混合并保持接触10min后,通过连续稀释并在TSA琼脂平板上计数,确定反应混合物中存活细菌的数量Tn. 如果出现下述情况见式(C.1),漂洗才视为有效:
C.5.1.3 污染溶液的制备 用30L自来水和30mL的包含10九次方CFU/mL铜绿假单胞菌(ATCC15442)悬浮液注入外部水箱。充分混合后,通过连续稀释并在TSA琼脂平板上计数,从而确定污染溶液中徽生物的精确浓度。 C.5.1.4 通过供水管路对清洗消毒器的污染 在准备好污染溶液并停用清洗消毒器水处理单元后,将经过测试的清洗消毒器连接到外部水箱(见图C.1)。然后启动清洗消毒器模拟污染周期,以确保清洗消毒器的所有内部管道中的污染溶液循环。 C.5.1.5 清洗消毒器污染水平的判定 在不同的测试过程中,通过运行采样周期,然后确定循环中流经清洗消毒器所有管道的水中的微生物浓度来确定清洗消毒器的污染水平。为此,在采样周期中,在清洗消毒器水箱中收集2L水。通过0.2 μm的过滤膜分别过滤10 mL、100 mL和1000mL的水。然后用3mL~50mL无菌蒸馏水漂洗过滤膜,置于计数培养基上,37℃培养 24 h。 培养后,计数并鉴定菌落形成单位的数量,并将结果表示为每100mL的多个菌落形成单位。 C.5.2 液体传输系统的消毒效果 C.5.2.1 方法1 程序如下: a) 安装清洗消毒器; b) 运行一个自身消毒周期; c) 运行一个采样周期; d) 判定清洗消毒器污染水平; e) 停用水处理系统(即去除过滤器,停用加热系统); f) 消毒外部水箱; g) 制备污染溶液; h) 通过供水管路污染清洗消毒器; i) 在清洗消毒器外室温(不低于20℃)下培养24 h; j) 正常连接清洗消毒器; k) 重新启动水处理系统; l) 运行一个自身消毒周期; m) 运行一个采样周期; n) 根据C.5.1.5判定清洗消毒器的污染水平; o) 如果结果分析显示,在步骤m)的采样超过10CFU/100mL,重复步骤 l)、m)和n)直至污染减少至不超过10 CFU/100mL; p) 报告减少污染水平至不超过10CFU/100mL,所需的自身消毒循环的数量。 注:在消毒周期(C.5.2.1步骤1之前判定污染水平是没有必要的,因为发生污染的程度具体与清洗消毒器的液体传输系统有关。进行这种采样也可以消除系统中显著的微生物污染。 C.5.2.2 方法2 程序如下: a) 安装清洗消毒器; b) 运行一个自身消毒周期: c) 运行一个采样周期; d) 判定清洗消毒器的污染水平; e) 停用水处理系统; f) 消毒外部水箱; g) 制备污染溶液; h) 通过供水系统污染清洗消毒器; i) 在清洗消毒器外室温(不低于20℃)下培养48 h; j) 正常连接清洗消毒器; k) 重新启用水处理系统; l) 运行一个标准的清洗和消毒周期; m) 运行一个采样周期; n) 根据 C.5.1.5判定清洗消毒器的污染水平; o) 将清洗消毒器放置在室温(不低于20℃)24 h; p) 重复阶段l)~o)4次; q) 运行一个自身消毒周期; r) 运行一个采样周期; s) 根据C.5.1.5判定清洗消毒器的污染水平; t) 如果结果分析显示在C.5.2.2 步骤1期间的采样出现多于10CFU/100mL,重复阶段r)、s)和t)直至污染减少至不多于10CFU/100 mL; u) 报告记录污染减少到不超过10CFU/100mL,所需的自身消毒周期数量。 附录 D (规范性附录) 负载化学消毒效果微生物检测所使用的指示物的制备与评价 D.1 原则 作为试验菌的生物指示物包含屎肠球菌(如ATCC 6057或其他等效菌种),应分别以至少10七次方个菌落形成单位(CFU)作为定量检测或以10五次方CFU~10六次方CFU作为定性检测。按D.4.1使用的非吸收性材料为载体,将试验菌悬浮于污染物中,并涂放于载体表面,并使其干燥。 生物指示物应能够证明机械和化学清洁/消毒的相互作用。单独机械去除(即冲洗)应在没有消毒剂的情况下进行评估。 D.2 试剂 ——溶液 A:将16 g NaCl;0.4 g KCl;0.4 g KH;PO、溶于1600mL蒸馏水中; ——溶液 B:将0.2 g CaCl:溶于200mL蒸馏水中; ——溶液C:将0.2 g MgSO、溶于200mL蒸馏水中; ——pH 7.4。 将溶液A、B和C进行灭菌,冷却完成后在无菌条件下进行混合,如果有要求则同时加入失活物质。 D.3 试验菌 D.3.1 概述 推荐用屎肠球菌(如ATCC 6057)进行试验。 屎肠球菌培养应每48h接种到新的胰蛋白胨大豆琼脂(TSA)上。培养温度控制在(36±1)℃。为了获得试验菌悬液,使用10mL的生理NaCl溶液清洗平板。通过离心冲洗悬液,然后用NaCl溶液进行再次悬浮并再次离心冲洗。随后,将试验菌添加到相应初始量的试验污染物[根据D.2.1的血液或牛血清白蛋白和粘蛋白试验菌悬液(RAM)]中。 该试验菌溶液(血液或RAM)的最小总量,按1.0X10八立方CFU/mL定量,或按10六立方CFU/mL~10七立方CFU/mL定性。 D.3.2 试验污染物 D.4 测试表面 D.4.1 概述 10 mmX130 mm,厚度约1.5mm的不锈钢作为测试表面。 D.4.2 清洁 测试表面应按照以下方案进行清洁: a) 将测试表面浸入丙酮ACS中,使用磁力搅拌器搅拌1min,去除表面油层; b) 将测试表面移至5%的清洁溶液中,并在75℃下加热10 min; c) 倒出清洁溶液; d) 用去离子水或蒸馏水冲洗,然后在75%乙醇中浸泡1min,以加速干燥。 用镊子取出测试表面,如上所述清洁,然后放置在干净的吸收性纸(如过滤纸)上使其干燥。 D.4.3 测试表面的污染 取0.1 mL的试验污染物样品均匀地涂抹分布在8mmX100 mm区域内,注意确保周边不受污染。 使该污染表面在(22±1)℃和(50±10)%的条件下持续保持24h以干燥。 每个污染表面的总菌落数(至少1X10七次方CFU)在衰减因数(RF)>5的条件下应有足够高,从而表明考虑到了检测范围。 D.5 贮存 生物指示物依照D.4进行制备,其应保存在4℃~8℃环境下,经过测试机构确认且符合D.4.3 微生物计数要求则满足测试用要求。 D.6 抗菌性测试 为了确定屎肠球菌的耐高温性,将20份生物指示物移至含有预先在水浴中加热至70℃的含有胰蛋白胨大豆培养基(TSB)的试管中。TSB的量的选取应能确保生物指示物完全浸没。 将含有载体的试管在70℃的水中浸泡10min,随后用冰水冷却。 随后在(36±1)℃的温度下培育24h,90%的载体应显示试验菌增长。 D.7 评价和验收标准 D.7.1 生物指示物的定量评价法 生物指示物的定量评价法通常用于型式检测。 将生物指示物放入清洗消毒器中并进行一个运行周期。消毒结束后,将生物指示物转移至无菌的工作条件下,并使其处于可视的监控之下以监控残留污染物。在报告中记录任意残留污染物信息。将生物指示物分别移至于pH为7.4的10mL含有适于消毒剂的中和剂的磷酸盐缓冲溶液中。 若未在清洗消毒器中处置,则增加3种已评估过的阳性对照品至符合D.2要求的10mL磷酸盐缓冲液中。 然后通过搅拌器(频率约500次/min)搅拌生物指示物的同时将其转移至磷酸盐缓冲液中,这个过程至少要维持20min以回收测试菌。随后在TSA(36±1)℃温度下培育72h,测定培养液中的菌落总数(CFU)。报告应记录所使用的方法(包括培养基类型和CFU的测定)。 衰减因数(RF)的计算见式(D.1):
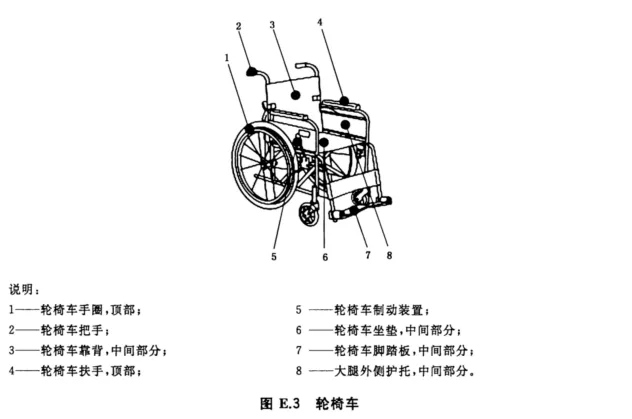
D.7.2 生物指示物的定性评估法 生物指示物的定性评估法常用于试验菌检测过程中对性能鉴定的重现性进行评估。 每次检测,0.1mL试验污染物中含有10五次方~10六次方的菌落数应通过阳性对照进行验证。 将生物指示物分别转移至无菌管中,并送回实验室。 胰蛋白胨大豆培养基(TSB)在(36±1)℃下培养72h;任何显示生长的培养基都是继代培养,借以监测测试菌。如出现阳性检查结果,则需要重复测试。 当没有任何暴露的生物指示物显示增长时,则认为其性能满足要求。 报告应反映单独通过机械作用(即在没有消毒剂的情况下清洗)的测试结果。 D.7.3 验收准则 从消毒剂中取样,并在(36±1)℃下培养72h。 将菌落转移到适宜的培养基上进行继代培养,借此监测测试菌和/或污染物(若出现)。 该试液中(分别在1000mL或2单位体积500mL溶液)内不得检测到微生物,任何观察到的非测试生物体的污染应记录在报告中。 若在周期或特殊检验中需对消毒剂溶液进行检测,则应在1000mL的样本内不得检测到试验菌。这种结果很可能仅仅当样品是即时制备时才会存在。 附录 E (资料性附录) 生物指示物的测试位置示例
END 推荐文章 |
|