国家标准 | GB 15979—2024 一次性使用卫生用品卫生要求发表时间:2024-08-20 11:02 GB 15979—2024 中华人民共和国国家标准
一次性使用卫生用品卫生要求 Hygienic requirements for disposable sanitary products
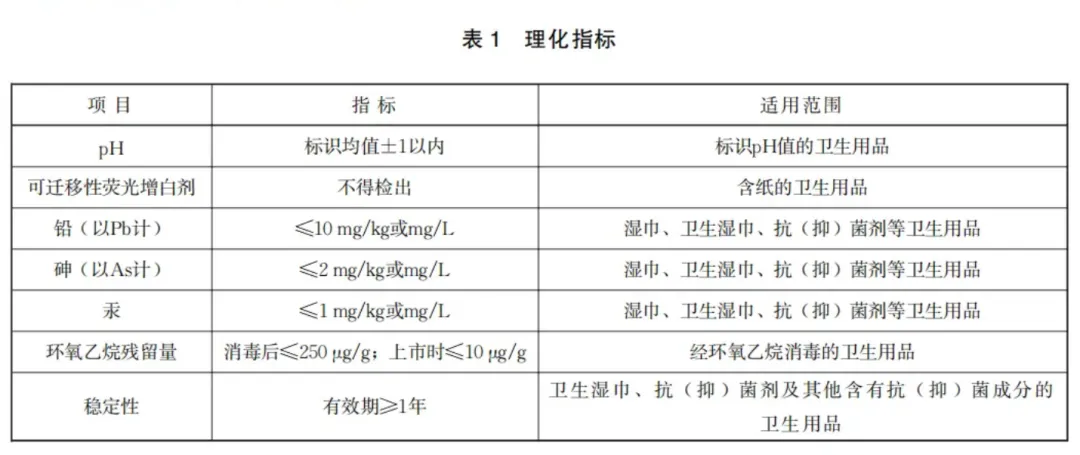
目 次 前言 1 范围 2 规范性引用文件 3 术语和定义 4 原材料卫生要求 5 生产过程卫生要求 6 产品卫生要求 7 检测方法 8 包装、运输和贮存 9 标识 10 标准的实施 附录 A(规范性) 生产环境卫生要求检测方法 附录 B(规范性) 产品微生物检测方法 附录 C(规范性) 消毒效果检测评价方法 附录 D(规范性) 产品环氧乙烷残留量检测方法 附录 E(规范性) 产品杀菌性能、抑菌性能与稳定性检测方法 附录 F(规范性) 产品毒理学试验方法 参考文献 前 言 一次性使用卫生用品卫生要求 本文件规定了一次性使用卫生用品的原材料卫生要求、生产过程卫生要求、产品卫生要求、包装、运输和贮存、标识要求,描述了相应的检测方法。 本文件适用于销售和使用的一次性使用卫生用品。 2 规范性引用文件 下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款。其中,注日期的引用文件,仅该日期对应的版本适用于本文件;不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。 GB/T 191 包装储运图示标志 GB 5749 生活饮用水卫生标准 GB/T 8939 卫生巾(护垫) GB/T 15981 消毒器械灭菌效果评价方法 GB/T 26367 胍类消毒剂卫生要求 GB/T 26369 季铵盐类消毒剂卫生要求 GB/T 27741 纸和纸板 可迁移性荧光增白剂的测定 GB/T 27947 酚类消毒剂卫生要求 GB/T 28004.1 纸尿裤 第1部分:婴儿纸尿裤 GB/T 28004.2 纸尿裤 第2部分:成人纸尿裤 GB/T 38496 消毒剂安全性毒理学评价程序和方法 GB 38598 消毒产品标签说明书通用要求 GB 50073 洁净厂房设计规范 WS/T 10009 消毒产品检测方法 中华人民共和国药典 (国家药品监督管理局、国家卫生健康委员会) 消毒产品生产企业卫生规范 [卫生部(2009年版)] 下列术语和定义适用于本文件。 3.1 一次性使用卫生用品 disposable sanitary products 与人体直接接触的,为达到人体生理卫生或抗菌、抑菌目的的一次性使用日常生活用品。 注:主要包括妇女经期卫生用品、排泄物卫生用品(不包括厕所用纸)和卫生湿巾、抗菌剂、抑菌剂等其他卫生用品。 3.2 卫生湿巾 hygiene wet wipes 以非织造布、织物、木浆复合布、木浆纸等为载体,适量添加生产用水和杀菌成分等原材料,对处理对象(如手、皮肤、黏膜及普通物体表面)具有清洁杀菌作用的湿巾。 注:仅包括与手、皮肤或(和)黏膜直接接触的卫生湿巾。 [来源:WS575-2017,3.2,有修改] 3.3 抗菌剂 antibacterial agent 直接接触人体完整皮肤或黏膜,具有一定杀菌(细菌和酵母菌)作用,但不以治疗疾病或者改善皮肤、黏膜的症状为目的的制剂。 注:不包括人体足部、眼睛、指甲、腋部、头皮、头发、鼻黏膜、肛肠等特定部位。 3.4 抑菌剂 bacteriostatic agent 直接接触人体完整皮肤或黏膜,具有一定抑菌(细菌和酵母菌)作用,但不以治疗疾病或者改善皮肤、黏膜的症状为目的的制剂。 注:不包括人体足部、眼睛、指甲、腋部、头皮、头发、鼻黏膜、肛肠等特定部位。 3.5 生产车间 production workshop 生产加工一次性使用卫生用品的场所。 注:包括配料间(区)、制作加工间(区)、分(灌)装间(区)、内包装间(区)等。其中,分装企业生产车间包括分(灌)装间(区)、内包装间(区)等。 [来源:《消毒产品生产企业卫生规范》(2009年版),第十二条,有修改] 3.6 高吸水材料 super absorbent materials 能够吸收自身质量数倍至数百倍液态水,吸收后具有保水和贮水能力的吸收体。 注:吸收体由高分子化合物、纸浆和无纺布等构成。 4 原材料卫生要求 a) 抗(抑)菌剂中不应添加列入《中华人民共和国药典》的药品及其同名原料(消毒防腐药、中药和抑菌剂除外,也不包括药用辅料和纯化水);疫苗、血清或毒素及其制品等用于产生主动或被动免疫的制剂,用于诊断免疫状态的制剂,蛋白、多肽制剂(溶菌酶、溶葡萄球菌酶除外);列入《化妆品安全技术规范》的禁用化学物质(碘除外);国家卫生健康行政部门规定的其他禁止使用的物质及其他对人体健康有明确危害的物质。 b) 卫生湿巾和其他具有抗(抑)菌功能的一次性使用卫生用品不应添加抗菌药物、抗真菌药物、抗病毒药物、激素类药物及其同名原料等和国家卫生健康行政部门规定的其他禁止使用的物质及其他对人体健康有明确危害的物质。 c) 非织造布、织物或其他原材料不应添加可迁移性荧光增白剂等禁用成分。 5 生产过程卫生要求 5.1 原辅料的购人、贮存、发放、使用应满足产品质量控制要求并符合管理制度规定。 5.2 生产环境卫生指标要求如下。 a) 抗(抑)菌剂生产车间空气应符合《消毒产品生产企业卫生规范》的要求,净化车间应符合GB 50073的要求;其他一次性使用卫生用品生产车间空气中菌落总数应小于或等于2500 CFU/m³(空气采样器法)或应小于或等于16 CFU/(皿·5min)(平皿暴露法)。 b) 直接接触未包装产品的工作台表面菌落总数应小于或等于20 CFU/cm²。 c) 直接接触未包装产品的工人手表面菌落总数应小于或等于300 CFU/只手(套)。 5.3 消毒级一次性使用卫生用品初始污染菌应小于或等于10000 CFU/g或CFU/mL。 5.4 应对用于消毒级一次性使用卫生用品的消毒方法进行消毒效果检测,并应符合以下要求: 6 产品卫生要求 6.1 感官要求 6.2 理化要求 6.2.1 理化指标应符合表1的规定。
6.2.2 卫生湿巾、抗(抑)菌剂和其他含有抗(抑)菌成分的一次性使用卫生用品有效成分含量应符合产品标签说明书标注的含量,其中用于手、皮肤、黏膜的产品,限用物质使用浓度应符合表2的规定。
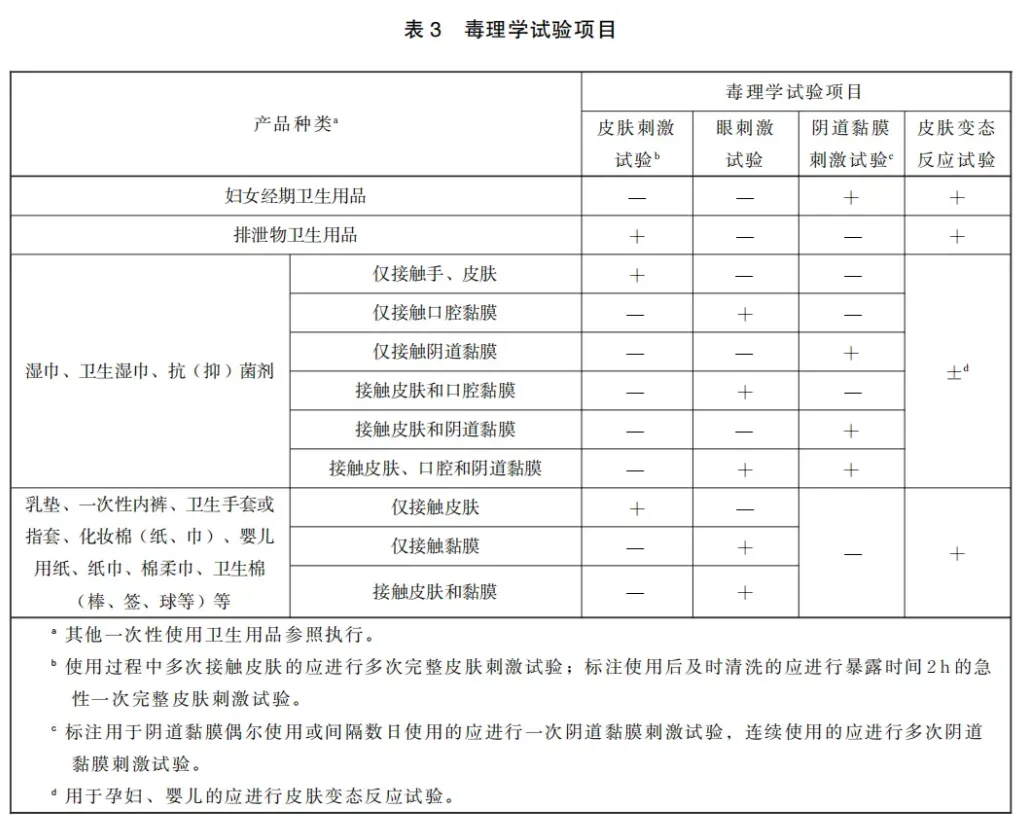
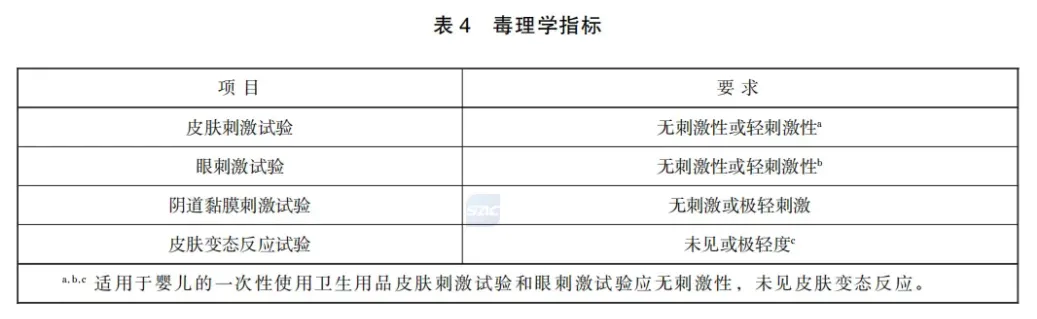
6.3 毒理学安全性要求 6.3.1 产品首次上市时,妇女经期卫生用品、排泄物卫生用品、湿巾、卫生湿巾、抗(抑)菌剂和其他卫生用品中乳垫、一次性内裤、卫生手套或指套、化妆棉(纸、巾)及婴儿用纸、纸巾、棉柔巾、卫生棉(棒、签、球等)等应进行毒理学试验。当原材料、生产工艺等发生变化可能影响产品毒性时,应按要求重新进行产品毒理学试验。 6.3.2 毒理学试验应按表3进行,指标符合表4的规定。
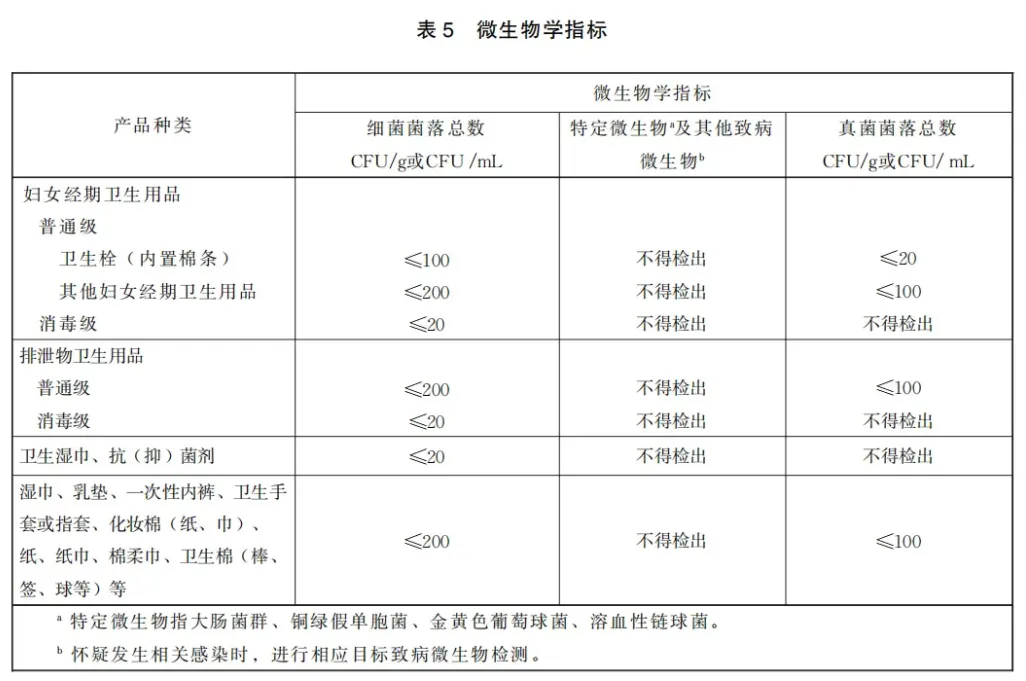
6.4 微生物学指标
6.5 卫生湿巾及抗(抑)菌卫生用品抗(抑)菌性能 6.5.1 卫生湿巾除应符合表5中的微生物学指标外,对大肠杆菌和金黄色葡萄球菌的杀菌率应大于或等于90%;如标明对致病性酵母菌有杀菌作用,对白色念珠菌的杀菌率应大于或等于90%;如标明对其他微生物有杀灭作用,对相应微生物的杀菌率应大于或等于90%。 6.5.2 具有抗菌功能的一次性使用卫生用品除应符合表5中的同类同级产品微生物学指标外,对大肠杆菌和金黄色葡萄球菌的杀菌率应大于或等于90%(振荡烧瓶试验方法杀菌率应大于26%);如标明对致病性酵母菌或其他微生物有杀灭作用,对白色念珠菌或相应微生物的杀菌率应达到上述要求。 6.5.3 具有抑菌功能的一次性使用卫生用品除应符合表5中的同类同级产品微生物学指标外,对大肠杆菌和金黄色葡萄球菌的抑菌率应大于或等于50%(振荡烧瓶试验方法抑菌率应大于26%,高吸水材料抑菌率应大于或等于99%)或抑菌环直径大于7.0mm;如标明对致病性酵母菌或其他微生物有抑菌作用,对白色念珠菌或相应微生物的抑菌率或抑菌环应达到上述要求。 7 检测方法 7.1 生产过程卫生要求检测方法 7.1.1 生产环境卫生要求检测方法按照附录A要求执行。 7.1.2 初始污染菌检测方法按照附录B要求执行。 7.1.3 消毒效果检测评价方法按照附录C要求执行。 7.2 产品卫生要求检测方法 7.2.1 产品外观采用目测、鼻嗅的方法进行测定。 7.2.2 卫生巾、卫生护垫等吸水产品pH按GB/T 8939的方法进行测定,其他产品pH有相应测定标准的按相应标准的方法进行测定,无相应测定标准的按WS/T 10009的方法进行测定。 7.2.3 可迁移性荧光增白剂:卫生巾(护垫)按GB/T8939的方法进行测定;纸尿裤分别按GB/T 28004.1、GB/T28004.2的方法进行测定;其他卫生用品按GB/T 27741的方法进行测定。 7.2.4 铅、砷、汞的检测按《化妆品安全技术规范》的方法进行测定。 7.2.5 产品环氧乙烷残留量测试方法按照附录D要求执行。 7.2.6 产品杀菌性能、抑菌性能与稳定性测试方法按照附录E要求执行。 7.2.7 葡萄糖酸氯己定、醋酸氯已定按照GB/T 26367及国家有关标准中规定的方法进行测定;2,4,4’-三氯-2’-羟基二苯醚按照GB/T 27947及国家有关标准中规定的方法进行测定;苯扎溴铵、苯扎氯铵按GB/T 26369及国家有关标准中规定的方法进行测定;其他有效成分含量按照WS/T 10009及国家有关标准中规定的方法进行测定;无法使用化学测定法的不测定。 7.2.8 产品毒理学试验方法按照附录F要求执行。 7.2.9 产品微生物检测方法按照附录B要求执行。 8 包装、运输和贮存 8.1 无外包装影响卫生质量的原材料应有包装;直接与产品接触的包装材料应无毒、无害、清洁;包装材料应保证产品在正常运输与贮存条件下不受污染。包装储运图示标志应符合GB/T 191要求。 8.2 应按照运输与贮存要求进行运输或贮存。 9 标识 9.1 产品标签说明书应符合GB 38598的有关要求。 9.2 消毒级产品还应在销售包装上标注“消毒级”字样、杀灭或抑制微生物类别、消毒方法和消毒日期;在运输包装上标注“消毒级”字样、生产日期及有效期或生产批号及限用使用日期。 9.3 原材料中有表2规定的限用物质时,应在包装上标识。 10 标准的实施 本文件实施之日前生产或进口的产品,在符合GB 15979—2002《一次性使用卫生用品卫生标准》的前提下,可以销售至产品标示的有效期(保质期)限为止。 附 录 A (规范性) 生产环境卫生要求检测方法 A.1 空气采样与测试方法 A.1.1 样品采集 A.1.2 菌落总数检测
A.2 工作台表面与工人手表面采样与测试方法 A.2.1 样品采集 A.2.2 菌落总数检测 将已采集的样品在4 h内送实验室,每支采样管充分振荡混匀(宜使用涡旋振荡器振荡)后取1.0 mL样液,放入灭菌平皿内,倾注营养琼脂培养基,每个样品平行接种两块平皿,置36 ℃±1℃培养48 h,计数平皿上菌落数。 工作台表面菌落总数计算见公式(A.2):
工人手菌落总数计算见公式(A.3):
附 录 B (规范性) 产品微生物检测方法 B.1 产品采集与样品处理 于同一批号的3个运输包装中至少抽取6件最小销售包装样品(若样品数量不能满足试验所需,则应相应增加采样数量),其中1/3样品用于检测,2/3样品用于留样。抽样的最小销售包装不应有破裂,检验前不得开启。 在空气洁净度5级净化条件下用无菌方法打开至少2个包装用于检测,从每个包装中取样,准确称取10.0 g士1.0 g样品。剪碎后加入到200 mL灭菌生理盐水中,充分混匀,得到一个生理盐水样液(若产品太轻,可称取2.5g±0.2g样品,加入50 mL灭菌生理盐水中)。液体产品吸取10.0 mL原液直接作样液。 如被检样品具有抑菌或抗菌作用,应选择适宜的中和剂中和,稀释梯度最高不超过1:100。无相应中和剂则选用薄膜过滤法去除样品中对微生物生长有影响的抑菌或抗菌成分,再按上述方法制备样液。如被检样品含有大量吸水树脂材料而导致不能吸出足够样液时,稀释液量可按每次50mL递增,直至能吸出足够测试用样液。在计算细菌菌落总数与真菌菌落总数时相应调整稀释度。 B.2 初始污染菌与细菌菌落总数检测方法 B.2.1 操作步骤 按B.1得到的生理盐水或中和剂样液自然沉降后取上清液,如需要可进行10倍系列稀释。选择适宜的稀释度进行菌落计数。共接种2个平皿,每个平皿中加入2.0 mL样液,然后用冷却至40℃~45 ℃左右熔化的营养琼脂培养基15 mL~20 mL倒入每个平皿内混合均匀。待琼脂凝固后翻转平皿置36℃±1℃培养48 h,计算平皿上的菌落数。 B.2.2 菌落计数 菌落呈片状生长的平皿不宜采用,确保2块平皿符合计数要求并进行菌落计数,按公式(B.1)计算结果:
首先选取平均菌落数在30 CFU~300 CFU之间的平皿。当菌落数小于或等于100 CFU/g或CFU/mL,按实有数报告,大于100 CFU/g或CFU/mL时采用二位有效数字;当2块营养琼脂培养基平皿上的细菌菌落总数为0 CFU时,如为固体应当报告细菌菌落总数小于5 CFU/g,如为液体按稀释倍数报告。 B.2.3 结果报告 B.3 大肠菌群检测方法 B.3.1 操作步骤 B.3.2 结果报告 凡乳糖胆盐发酵管产酸产气,乳糖发酵管产酸产气,在伊红美蓝平皿上有典型大肠菌群菌落,革兰染色为阴性无芽孢杆菌,可报告被检样品检出大肠菌群。 B.4 铜绿假单胞菌检测方法 B.4.1 操作步骤 B.4.2 结果报告 被检样品经增菌分离培养后,证实为革兰阴性杆菌,氧化酶及绿脓菌素试验均为阳性者,即可报告被检样品中检出铜绿假单胞菌。如绿脓菌素试验阴性而液化明胶、硝酸盐还原产气和42℃生长试验三者皆为阳性时,仍可报告被检样品中检出铜绿假单胞菌。 B.5 金黄色葡萄球菌检测方法 B.5.1 操作步骤 B.5.2 结果报告 凡在琼脂平皿上有可疑菌落生长,镜检为革兰阳性呈葡萄状排列的球菌,并能发酵甘露醇产酸,血浆凝固酶试验阳性者,可报告被检样品检出金黄色葡萄球菌。 B.6 溶血性链球菌检测方法 B.6.1 操作步骤 B.6.2 结果报告 镜检革兰阳性链状排列球菌,血琼脂平皿上呈现溶血圈,链激酶和杆菌肽试验阳性,可报告被检样品检出溶血性链球菌。 B.7 真菌菌落总数检测方法 B.7.1 操作步骤 按B.1得到的生理盐水或中和剂样液自然沉降后取上清液,如需要可进行10倍系列稀释。选择适宜的稀释度进行真菌菌落计数。共接种2个平皿,每个平皿中加入2.0 mL样液,然后用冷却至40℃~45℃熔化的沙堡弱琼脂培养基或改良沙堡弱琼脂培养基15 mL~20 mL倒入每个平皿内混合均匀,琼脂凝固后翻转平皿置25℃±1 ℃(沙堡弱琼脂培养基)或28 ℃±1 ℃(改良沙堡弱琼脂培养基)培养72 h,分别于第 24 h、第 48 h、第72 h观察,计算平皿上的菌落数,如果发现菌落蔓延,以前一次的菌落计数为准。 B.7.2 菌落计数 菌落呈片状生长的平皿不应采用;确保2块平皿符合计数要求并进行菌落计数,按公式(B.2)计算结果:
当菌落数小于或等于100 CFU CFU/g或CFU/mL时,按实有数报告;当大于100 CFU/g或CFU/mL时采用二位有效数字;当2块沙堡弱琼脂培养基或改良沙堡弱琼脂培养基平皿上真菌菌落总数为0 CFU时,如为固体应报告真菌菌落总数小于5 CFU/g,如为液体按稀释倍数报告。 B.7.3结果报告 B.8 真菌定性检测方法 B.8.1 操作步骤 取样液5.0 mL加入到50 mL沙堡弱液体培养基或改良沙堡弱液体培养基中,25℃±1 ℃培养 72 h,逐日观察有无真菌生长。 B.8.2 结果报告 如培养管澄清,则说明无真菌生长,可报告被检样品未检出真菌;如培养管混浊,应转种沙堡弱琼脂培养基进行培养,证实有真菌生长,可报告被检样品检出真菌。 附 录 C (规范性) 消毒效果监测评价方法 C.1 环氧乙烷消毒 按GB/T 15981的方法进行评价。 C.2 电离辐射消毒 C.3 压力蒸汽消毒 按GB/T 15981的方法进行评价。 附 录 D (规范性) 产品环氧乙烷残留量检测方法 D.1 样品采集 D.2 仪器与试剂 D.2.1 仪器 D.2.1.1 气相色谱仪,配有火焰离子化检测器(FID)。 D.2.1.2 分析天平,精确到0.1 mg。 D.2.1.3 机械振荡器。 D.2.1.4 冰箱:能使样品保存在2℃~8℃之间。 D.2.1.5 气体调节器:用于开、关环氧乙烷气瓶。 D.2.1.6 气密性注射器:容量为1.0 mL、10.0 mL、50 mL、100 mL,用于标准气体配制及把标准气体注入液相色谱。 D.2.1.7 微量注射器:容量为10 μL,用于向气相色谱仪中注入浸提溶液。 D.2.1.8 平底螺盖瓶:体积能够容纳样品及浸提溶液,具有聚四氟乙烯(PTFE)衬垫的硅橡胶塞,用于样品浸提。 D.2.2 试剂 D.2.2.1 环氧乙烷:装在适当的气瓶中的有证标准气体。 D.2.2.2 水:纯度适合于气相色谱。 D.2.2.3 载气和辅助气体。载气:高纯氮气(99.999%)。辅助气体:氢气、空气。 D.3 操作步骤 D.3.1 标准气体配制
D.3.2 样品处理 至少取2个最小包装产品,将其剪碎,随机精确称取0.5 g~2.0 g,放入适当体积的平底螺盖瓶中,加入2.0 mL~5.0 mL去离子水,确保样品完全浸没于浸提溶液中,加盖密封后充分摇匀,放置4h或振荡30 min待用。如被检样品为吸水树脂材料产品,可适当增加去离子水量,以确保至少可吸出2 mL样品浸提溶液。如果检测不能马上进行,则将浸提溶液从样品中分离出来,密封于有聚四氟乙烯衬垫的瓶中盖紧。任何盛有标准溶液或浸提液的管瓶,其顶端空间应少于总体积的10%,浸提溶液可在5℃±3℃的冰箱中暂时贮存,并于浸提当天检测。 D.3.3 分析 待仪器稳定后,在同样条件下,环氧乙烷标准气体各进样1.0 mL,待分析样品(样品浸提溶液)各进样1.0 μL,每一样液平行做2次测定。 根据保留时间定性,根据峰面积(或峰高)进行定量计算,取平均值。 D.3.4 仪器操作参考条件 D.3.5 计算 以所进环氧乙烷标准气的微克数对所得峰面积(或峰高)作环氧乙烷工作曲线。 以样品中环氧乙烷对应的峰面积(或峰高)在工作曲线上求得环氧乙烷的量A(ug),并以公式(D.2)求得产品中环氧乙烷的残留量。
附 录 E (规范性) 产品杀菌性能、抑菌性能与稳定性检测方法 E.1 样品采集 于同一批号3个运输包装中至少抽取6件最小销售包装样品(若样品数量不能满足试验所需,则应相应增加采样数量),其中1/3样品用于抑菌、抗菌或杀菌性能测试,2/3样品用于留样;如需做稳定性测试,样品数量再作相应增加。 E.2 试验方法选择原则 E.3 试验材料 E.3.1 试验菌 E.3.1.1 试验菌种类 细菌:大肠杆菌(8099或CICC 10899)或大肠杆菌(ATCC 25922),金黄色葡萄球菌(ATCC 6538或ATCC 25923)。 酵母菌:白色念珠菌(ATCC 10231)。 根据产品特定用途所需用的其他菌株。 E.3.1.2 试验菌悬液制备 取冷冻条件下保存的菌种(冻干管、甘油管或磁珠),在无菌操作下打开,加入适量营养肉汤,轻柔吹吸数次,使菌种融化分散。取含5.0 mL~10.0 mL营养肉汤培养基试管,滴入少许菌种悬液,36 ℃±1℃培养18 h~24 h。用接种环取第1代培养的菌悬液,划线接种于营养琼脂培养基平皿上,36 ℃±1℃培养 18 h~24 h。挑取上述第2代培养物中典型菌落,接种于营养琼脂斜面,36℃±1℃培养18 h~24 h即为第3代培养物。取菌株第3代~第6代的营养琼脂培养基(酵母菌为沙堡弱琼脂培养基)新鲜斜面培养物(18 h~24 h),用5.0 mL 0.03 mol/L磷酸盐缓冲液(简称PBS)洗下菌苔,使菌悬浮均匀后用PBS稀释至所需浓度(浸渍抑菌试验使用肉汤对培养液进行稀释)。 E.3.2 试验器材 E.4 卫生湿巾杀菌性能试验 E.4.1 适用范围 适用于添加有杀菌成分的卫生湿巾或可溶性抗菌物质的载体类产品的抗菌性能效果鉴定。 E.4.2 中和剂鉴定试验 第1组:5.0mL中和剂+染菌对照片→培养; 第2组:(样片+5.0mL 中和剂)+染菌对照片→培养; 第3组:5.0mL PBS+染菌对照片→培养; 第4组:同批次PBS 0.5 mL+中和剂 0.5 mL+培养基→培养。 E.4.3 试验步骤 对照样片应与试验样片同等材质、同等大小但不含杀菌成分,且经灭菌处理;将100L试验菌悬液滴于对照样片上,回收菌数应为1.0X10⁴CFU/片~9.0X10⁴CFU/片。 取试验样片(大小20mmX30mm,厚度应确保菌悬液被完全吸收不渗漏,如被测试样品厚度无法满足要求,可增加片数)和对照样片各1片分别置于无菌平皿内,用新鲜制备的菌悬液分别在每个试验样片与对照样片上滴加100μL,均匀涂布,开始计时,作用至说明书规定时间,用无菌镊子分别将试验样片和对照样片放入5.0mL相应中和剂的试管内,充分混匀,中和作用10min后进行10倍系列稀释,选择适宜稀释度,吸取1.0mL接种平皿,每管接种2个平皿,将冷至40℃~45 ℃熔化的营养琼脂培养基(细菌)或沙堡弱琼脂培养基(酵母菌),倾注于已加入样液的平皿中,每平皿15mL~20 mL,转动平皿,使其充分混匀,琼脂凝固后翻转平皿,36℃±1℃培养48 h(细菌)或72 h(酵母菌),进行活菌菌落计数。 重复试验3次,计算杀菌率。 E.4.4 计算 杀菌率计算见公式(E.1):
E.4.5 评价标准 各次杀菌率均大于或等于90%,产品有杀菌作用。 卫生湿巾的最长杀菌作用时间不应超过5 min。 E.5 产品抗菌性能试验 E.5.1 抗菌剂杀菌性能试验 E.5.1.1 适用范围 适用于液体抗菌剂或卫生湿巾挤出液对微生物抗菌效果的测定。 E.5.1.2 中和剂鉴定试验 第1组:4.5 mL中和剂+0.4 mL硬水+0.1 mL菌悬液→培养; 第2组:(0.4 mL样液十4.5 mL中和剂)+0.1 mL菌悬液→培养; 第3组:4.9 mL PBS +0.1 mL菌悬液→培养; 第4组:同批次PBS 0.5mL+中和剂0.5 mL+培养基→培养。 E.5.1.3 试验步骤 E.5.1.4 计算
E.5.1.5 评价标准 说明书规定时间的各次杀菌率均大于或等于90%,判有抗菌作用;说明书规定时间的各次杀菌率均大于或等于99%,判有较强抗菌作用。 抗菌剂的最长杀菌作用时间不应超过5min。 E.5.2 载体浸泡定量杀菌试验 E.5.2.1 适用范围 适用于黏稠状(半固体)抗菌产品如抗菌洗手液等对微生物抗菌效果的鉴定。 E.5.2.2 染菌载体制备 取试验菌24 h新鲜斜面培养物用PBS洗下,用PBS稀释至约5.0X10⁶ CFU/mL~5.0x10⁷ CFU/mL制成菌悬液备用。用微量移液器滴染10μL菌悬液于灭菌载体上,35℃±1℃烘干或室温晾干备用。 E.5.2.3 中和剂鉴定试验 E.5.2.3.1 试验分组 第1组:5.0 mL中和剂+染菌载体→培养。 第2组:(含抗菌剂的载体+5.0 mL中和剂)+染菌载体→培养。 第3组:5.0 mL稀释液+染菌载体→培养。 第4组:稀释液+中和剂+培养基→培养。 E.5.2.3.2 试验步骤 根据试验分组,准备试管和平皿,依次进行编号。 第1组:取5.0 mL中和剂于无菌平皿中,置20℃±1℃水浴5 min,加入1片染菌载体,作用10 min,取出菌片放入5.0 mL中和剂试管内,作用10 min后,置涡旋振荡器上振荡1 min或在手掌上用力振打80次,将试验菌洗下,用中和剂做10倍系列稀释后,选择适宜稀释度,分别吸取1.0 mL接种于2个平皿中,做活菌培养计数。 第2组:取5.0 mL中和剂于无菌平皿内,加入1片沾有抗菌样品的载体,混匀,置20℃±1 ℃水浴作用10 min制成中和产物。再用无菌镊子取1片染菌载体,浸于中和产物中作用10 min后,用无菌镊子取出染菌载体移入含5.0 mL中和产物试管中,作用10 min,振荡,将试验菌洗下,用中和产物做10倍系列稀释.选适宜稀释度分别吸取1.0 mL接种于2个平皿中,做活菌培养计数。 第3组:取5.0 mL PBS于无菌平皿中,置20℃±1℃水浴5 min,加入1片染菌载体,作用10 min,取出菌片放入5.0 mL PBS试管内,作用10 min后,振荡,将试验菌洗下,用PBS做10倍系列稀释,选适宜稀释度分别吸取1.0 mL接种于2个平皿中,做活菌培养计数。 第4组:分别吸取稀释液(PBS)与中和剂各1.0 mL于同一无菌平皿内,倒入同批次的培养基15 mL~20 mL,培养观察。 E.5.2.3.3 结果判定 第1组、第2组和第3组有相似量试验菌生长,且菌量在1.0X10⁴ CFU/片~9.0X10⁴ CFU/片。计算组间菌落数误差率[计算见公式(E.2)],其组间菌落数误差率应不超过15%。 第4组无菌生长,否则,说明试剂有污染,应更换无污染的试剂重新进行试验。 试验3次,每次试验均应符合以上要求。 E.5.2.4 试验步骤 按5.0 g/片的量称取抗菌样品于无菌平皿内,置20℃±1℃水浴5 min,用无菌镊子取染菌载体,使载体完全浸没于抗菌样品中,立即计时。 待染菌载体与抗菌剂相互作用至各预定时间(以说明书规定时间为T,时间分别为0.5T、T、1.5T),分别取染菌载体加入5.0mL中和剂试管中,混匀。 经中和剂作用10 min后,振荡,将试验菌洗下,分别吸取1.0 mL样液,按活菌培养计数方法测定存活菌数,每管样液接种2个平皿。如平板上生长的菌落数较多时,可用PBS进行系列10倍稀释后,再进行活菌培养计数。 取与试验样品同质材料不含抗菌成分的对照样品代替抗菌样品浸泡2片染菌载体,进行平行试验,作为阳性对照。阳性对照回收菌量为1.0X10⁴ CFU/片~9.0X10⁴ CFU/片。取同批次稀释液、中和剂、培养基作阴性对照。 所有试验样品和对照样品均在36℃±1℃培养48 h(细菌)或72 h(酵母菌),进行活菌菌落计数。重复试验3次,计算杀菌率。 E.5.2.5 杀菌率计算 杀菌率计算见公式(E.4):
E.5.2.6 评价标准 说明书规定时间的各次杀菌率均大于或等于90%,判有抗菌作用;说明书规定时间的各次杀菌率均大于或等于99%,判有较强抗菌作用。 E.5.3 载体杀菌试验 E.5.3.1 适用范围 适用于添加有杀菌剂的卫生湿巾或可溶性抗菌物质的载体类产品抗菌性能效果的鉴定。 E.5.3.2 菌悬液配制及样片制备 取试验菌24 h新鲜斜面培养物用PBS洗下,用PBS稀释至1.0X10⁵ CFU/mL~9.0X10⁵ CFU/mL,制成菌悬液备用。 用无菌剪刀将抗菌产品和材质相同但不含抗菌成分的对照样品分别剪成20 mmX30 mm样片备用。试验时滴加100 μL菌悬液。对照样片染菌前需经121℃15 min灭菌处理。 E.5.3.3 中和剂鉴定试验 E.5.3.3.1 试验分组 第1组:5.0 mL中和剂+染菌对照样片→培养。 第2组:(5.0 mL中和剂+抗菌样片)+染菌对照样片→培养。 第3组:5.0 mL稀释液+染菌对照样片→培养。 第4组:稀释液+中和剂+培养基→培养。 E.5.3.3.2 试验步骤 根据试验分组,准备试管和平皿,依次进行编号。 第1组:取5.0 mL中和剂于无菌试管内,置20℃±1℃水浴5 min,用无菌镊子取1片染菌对照样片加入试管内,作用10 min,振荡将试验菌洗下,用中和剂做10倍系列稀释后选择适宜稀释度分别吸取1.0 mL接种于2个平皿中,做活菌培养计数。 第2组:取5.0 mL中和剂于无菌试管内,用无菌镊子取1片抗菌样片加入试管内,振荡混匀置20℃±1℃水浴作用10 min制成中和产物,再夹入1片染菌对照样片,作用10 min,振荡将试验菌洗下,用中和产物做10倍系列稀释,选择适宜稀释度分别吸取1.0 mL接种2个平皿,做活菌培养计数。 第3组:取5.0 mL PBS于无菌试管内,置20℃±1℃水浴5 min,用无菌镊子取1片染菌对照样片加入试管内,作用10 min,振荡将试验菌洗下,用PBS做10倍系列稀释后选择适宜稀释度分别吸取1.0 mL接种2个平皿,做活菌培养计数。 第4组:分别吸取稀释液与中和剂各1.0 mL于同一无菌平皿内,倾注同批次的培养基15 mL~20 mL,培养观察。 E.5.3.3.3 结果判定 第1组、第2组和第3组有相似量试验菌生长,且菌量在1.0X10⁴ CFU/片~9.0X10⁴ CFU/片。计算组间菌落数误差率,其组问菌落数误差率应不超过15%。 第4组无菌生长,否则,说明试剂有污染,应更换无污染的试剂重新进行试验。 试验重复3次,每次试验均应符合以上要求。 E.5.3.4 试验步骤 取无菌平皿,用无菌镊子取3片试验样片,勿重叠,置20℃±1℃水浴5 min,在每一样片上滴加0.1 mL试验用菌悬液,立即计时。 待试验菌与样片相互作用至各预定时间(以说明书规定时间为T,时间分别为0.5 T、T、1.5 T),分别夹取染菌样片加于5.0 mL中和剂试管中,混匀。 经中和剂作用10 min后,振荡将试验菌洗下,分别吸取1.0 mL样液,按活菌培养计数方法测定存活菌数,每管样液接种2个平皿。如平板上生长的菌落数较多时,可10倍系列稀释后,再进行活菌培养计数。 同时用不含杀菌成分,其他成分相同的对照样片2片代替试验样片,进行平行试验,作为阳性对照。阳性对照回收菌落数在1.0X10⁴ CFU/片~9.0X10⁴ CFU/片。取试验同批次稀释液、中和剂、培养基作阴性对照。 所有试验样本和对照样本均在36℃±1℃培养48 h(细菌)或72 h(酵母菌),进行活菌菌落计数。试验重复3次,计算杀菌率。 E.5.3.5 杀菌率计算 杀菌率计算见公式(E.5):
E.5.3.6 结果判定 各次试验说明书规定时间的杀菌率大于或等于90%,判有抗菌作用;各次试验说明书规定时间的杀菌率大于或等于99%,判有较强抗菌作用。 E.5.4 浸渍杀菌试验 E.5.4.1 适用范围 适用于抗菌毛巾、抗菌棉袜、抗菌棉布等含有溶出性抗菌材料的抗菌织物对微生物抗菌效果的试验。 E.5.4.2 试样和菌悬液制备 E.5.4.2.1 试样 在距试样布边10.0 cm以上、离布端1.0 m以上部位,剪取直径为5.0 cm的圆形试样若干,取3份试样分别装于3个锥形瓶中,盖好瓶口备用(需用试样数量要根据纤维类别及织物织法而定,以能吸收1.0 mL菌悬液且锥形瓶中不留残液为度)。另同法剪取与试样相同材质但不含抗菌剂对照织物若干,取2份分别装于2个锥形瓶中,盖好瓶口,121℃灭菌15 min备用。 E.5.4.2.2 菌悬液的制备 用接种环将保存的菌种以划线法接种到营养琼脂平皿,36℃±1℃培养18 h~24 h,取典型的菌落移种到含肉汤培养基的锥形瓶中,36℃±1℃培养24 h,用肉汤对培养液进行系列稀释,使菌悬液的含菌量为1.0X10⁵ CFU/mL~5.0X10⁵ CFU/mL。 E.5.4.3 试验步骤 分别取1.0 mL菌悬液加入2份准备好的锥形瓶内试样和1份对照织物上,确保其均匀分布,且锥形瓶中不留多余液,封好瓶口,以防蒸发,造成细菌死亡。 分别在一个盛有已接种菌悬液的试样和对照织物的锥形瓶中加入100 mL中和剂,置涡旋振荡器上振荡1 min洗涤细菌,取1.0 mL进行10倍系列稀释,选适当稀释度以倾注法接种平皿,作为“0”接触时间样品和对照织物上的细菌数。 将另一个装有已接种菌悬液试样的锥形瓶于36℃±1℃培养20 h±2 h,加入100 mL中和剂,置涡旋振荡器上振荡1 min洗涤细菌,取1.0 mL进行10倍系列稀释,选适当稀释度以倾注法接种平皿,作为试验组。 阴性对照组:试样不接种菌悬液,在“0”接触时间加入100 mL中和剂,置涡旋振荡器上振荡1 min取样,接种平皿。 阳性对照组:另取1个装有对照织物的锥形烧瓶,接种1.0 mL菌悬液后,在36℃±1℃ 培养 20 h±2 h,加入100 mL PBS,置涡旋振荡器上振荡1 min洗涤细菌,取1.0 mL进行10倍系列稀释,选适当稀释度以倾注法接种平皿。 将阴性和阳性对照样品与试验组样品接种的平皿一并于36℃±1℃培养48 h,计数菌落数。试验3次。 产品对白色念珠菌等其他微生物抗菌效果的测试方法同上,选择相应的菌株、培养基和培养条件。 E.5.4.4 杀菌率的计算 杀菌率计算见公式(E.6):
E.5.4.5 评价标准 E.5.5 振荡烧瓶试验 E.5.5.1 适用范围 适用于对含非溶出性抗菌物质抗菌产品的抗菌性能检测。 注1:在进行振荡烧瓶试验前,需要鉴定其抗菌成分是否可溶出,如果有溶出性抗菌材料,参照可溶出抗菌材料检测,无溶出性抗菌材料,选用振荡烧瓶法进行。 注2:非溶出性抗菌材料的鉴定:将样品置于无菌蒸馏水浸泡24 h(通过预试验,吸取的浸泡液需满足后续检测要求),取浸泡液参照E.5.1抗菌剂杀菌性能试验检验是否有抗菌效果。如果无抗菌效果,说明样品属非溶出性抗菌材料,进行振荡烧瓶试验。 E.5.5.2 试验步骤 E.5.5.3 计算公式 杀菌率计算见公式(E.7):  E.5.5.4 评价标准 E.5.5.4.1 各次试验阴性对照均应无菌生长。 E.5.5.4.2 不加样片组活菌计数在1.0X10⁴ CFU/片~5.0X10⁴ CFU/片之间,且样品振荡前后平均菌落数差值在10%以内,试验有效。 E.5.5.4.3 各次试验中,试验样片杀菌率与对照样片杀菌率的差值大于26%,产品具有抗菌作用。 E.5.5.4.4 抗菌纤维类产品的最长抗菌作用时间不应超过1 h。 E.5.5.5 注意事项 E.5.5.5.1 振荡前应将振荡摇床上的锥形瓶固定牢,以免碰破。 E.5.5.5.2 试验中,在试验误差允许的范围内,如果试验样片和对照样片出现振荡后菌落数高于振荡前菌落数的情况,其杀菌率可按“0”计算。 E.6 产品抑菌性能试验 E.6.1 抑菌剂抑菌性能试验 E.6.1.1 适用范围 适用于液体抑菌剂对微生物抑菌效果的测定。 E.6.1.2 试验步骤 E.6.1.3 计算  E.6.1.4 评价标准 各次试验抑菌率Y均大于或等于50%到小于90%之间,产品有抑菌作用;各次试验抑菌率均大于或等于90%,产品有较强抑菌作用。 抑菌剂的最长抑菌作用时间不应超过5min。 E.6.1.5 注意事项 若由原液接种的平皿上菌落数大于300CFU或难以计数时,才需进行10倍系列稀释,选择适宜稀释度平皿作活菌菌落计数。 E.6.2 载体浸泡定量抑菌试验 E.6.2.1 适用范围 适用于黏稠状(半固体)抑菌产品(如抑菌洗手液等)对微生物抑菌效果的测定。 E.6.2.2 试验步骤 取试验菌24h新鲜斜面培养物用PBS洗下,用PBS稀释至约5.0X10⁶ CFU/mL~5.0x10⁷ CFU/mL制成菌悬液备用。用微量移液器滴染10 μL菌悬液于灭菌载体上,35 ℃±1 ℃烘干或室温晾干备用。 按5.0 g/片的量称取样品于无菌平皿内,置20℃±1℃水浴5 min,用无菌镊子取染菌载体,使载体完全浸没于样品中,立即计时。待染菌载体与样品相互作用至说明书的规定时间,分别取染菌载体加入5.0 mL PBS试管中,混匀,振荡,将试验菌洗下,分别吸取1.0 mL样液,按活菌培养计数方法测定存活菌数,每管样液接种2个平皿。如平板上生长的菌落数较多时,可用PBS进行10倍系列稀释后,再进行活菌培养计数。取10.0 g与试验样品同质材料不含抑菌成分的对照样品浸泡2片染菌载体进行平行试验,作为阳性对照。阳性对照回收菌量为1.0X10⁴ CFU/片~9.0X10⁴ CFU/片。取同批次PBS、培养基作阴性对照。所有试验样品和对照样品接种平皿均在36℃±1 ℃培养48 h(细菌)或72 h(酵母菌),进行活菌菌落计数。重复试验3次,计算抑菌率。 抑菌率计算见公式(E.9):  E.6.2.4 评价标准 各次试验抑菌率Y均大于或等于50%到小于90%之间,判有抑菌作用;各次试验抑菌率均大于或等于90%,判有较强抑菌作用。 E.6.3 载体抑菌试验 E.6.3.1 适用范围 适用于含溶出性抑菌成分的湿巾、无纺布口罩、卫生巾、护垫、尿布等固体类抑菌产品对微生物抑菌效果的测定。 E.6.3.2 试验步骤 取试验菌24 h新鲜斜面培养物用PBS洗下,用PBS稀释至5.0X10⁵ CFU/mL~5.0X10⁶ CFU/mL,制成菌悬液备用。 用灭菌剪刀在无菌条件下将试验样品和对照样品分别剪成20 mmX30 mm样片备用。试验时滴加100 μL菌悬液。对照样片染菌前需经压力蒸汽灭菌。取无菌平皿,用无菌镊子取2片试验样片,勿重叠,置20 ℃±1 ℃水浴5 min,在每一样片上滴加100 μL试验用菌悬液,立即计时。待试验菌与样片接触作用至说明书的规定时间,分别夹取染菌样片加于5.0mL PBS试管中,混匀。振荡洗脱,分别吸取1.0 mL样液,按活菌培养计数方法测定存活菌数,每管样液接种2个平皿。如平板上生长的菌落数较多时,可10倍系列稀释后,再进行活菌培养计数。 同时用与试验样品同质材料不含抑菌成分的对照样片2片代替试验样片进行试验,作为阳性对照,阳性对照回收菌量为1.0X10⁴ CFU/片~9.0X10⁴ CFU/片;取同批次PBS、培养基作阴性对照。 所有试验样本和对照样本均在36℃±1℃培养48 h(细菌)或72 h(酵母菌),进行活菌菌落计数。试验重复3次,计算抑菌率。 E.6.3.3 抑菌率计算 抑菌率计算见公式(E.10):  E.6.3.4 结果判定 各次试验抑菌率Y大于或等于50%到小于90%之间,判有抑菌作用;各次试验抑菌率大于或等于90%,判有较强抑菌作用。 E.6.4 抑菌环试验 E.6.4.1 适用范围 适用于含溶出性抑菌物质,或可制成直径为5.0 mm片状物的固体抑菌产品的抑菌效果鉴定;也可用于鉴别抑菌产品中是否含有可溶性抑菌物质。 E.6.4.2 载体和器材 E.6.4.3 操作步骤 测量抑菌环时,应选均匀而完全无菌生长的抑菌环进行。测量其直径应以抑菌环外沿为界。 E.6.4.4 评价标准 E.6.5 浸渍抑菌试验 E.6.5.1 适用范围 适用于溶出性抑菌织物(如抑菌毛巾、内衣等)抑菌效果的测定。 E.6.5.2 试样和菌悬液制备 E.6.5.2.1 试样 在距试样布边10.0 cm以上、离布端1.0 m以上部位,剪取直径为5.0 cm的圆形试样若干,取3份试样分别装于3个锥形瓶中,盖好瓶口备用(需用试样数量要根据纤维类别及织物织法而定,以能吸收1.0 mL菌悬液且锥形瓶中不留残液为度)。另同法剪取与试样相同材质但不含抑菌剂对照织物若干,取2份分别装于2个锥形瓶中,盖好瓶口,121℃灭菌15 min备用。 E.6.5.2.2 菌悬液的制备 用接种环将保存的菌种以划线法接种到营养琼脂平皿,36 ℃±1 ℃培养 18 h~24 h,取典型的菌落移种到含肉汤培养基的锥形瓶中,36 ℃±1 ℃培养24h,用肉汤对培养液进行系列稀释,使菌悬液的含菌量为1.0X10⁵ CFU/mL~5.0X10⁵ CFU/mL. E.6.5.3 试验步骤 分别取 1.0 mL菌悬液加入2份准备好的锥形瓶内试样和1份对照织物上,确保其均匀分布,且锥形瓶中不留多余液,封好瓶口,以防蒸发造成细菌死亡。分别在一个盛有已接种菌悬液的试样和对照织物的锥形瓶中加入100 mL PBS,置涡旋振荡器上振荡1 min洗涤细菌,分别吸取1.0 mL样液或10倍系列稀释液接种2个平皿,作为“0”接触时间样本和对照织物上的细菌数。 将另一个装有已接种菌悬液试样的锥形瓶于36℃±1℃培养20 h±2 h,加入100 mL PBS,置涡旋振荡器上振荡1 min洗涤细菌,分别吸取1.0 mL样液或10倍系列稀释液接种2个平皿,作为试验组。 阴性对照组,试样不接种菌悬液,在“0”接触时间加入100 mL PBS,置涡旋振荡器上振荡1 min 取样,接种平皿。 阳性对照组,另取1个装有对照织物的锥形烧瓶,接种1.0 mL菌悬液后,在36℃±1℃培养 20 h±2 h,加入100 mL PBS,置涡旋振荡器上振荡1 min洗涤细菌,分别吸取1.0 mL样液或10倍系列稀释液接种2个平皿。将阴性和阳性对照样品与试验组样品接种的平皿一并于36 ℃±1℃培养48 h,计数菌落数。重复试验3次,计算抑菌率。 E.6.5.4 计算抑菌率 抑菌率计算见公式(E.11):  E.6.5.5 评价标准 E.6.6 振荡烧瓶试验 E.6.6.1 适用范围 适用于对含非溶出性抑菌物质的材料的抑菌性能检测。 E.6.6.2 试验步骤 同E.5.5.2。 E.6.6.3 计算 抑菌率计算见公式(E.12):
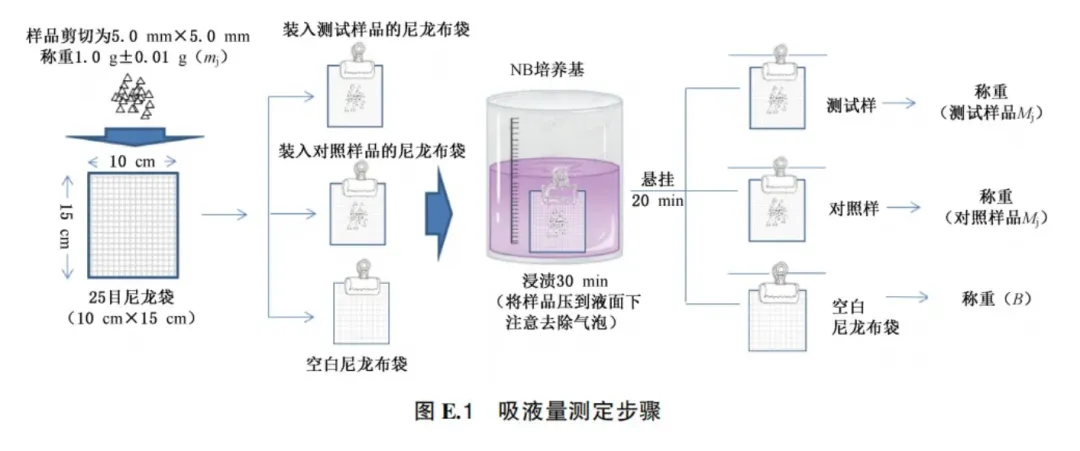
E.6.6.4 评价标准 E.6.7 高吸水材料抑菌性能试验 E.6.7.1 适用范围 本试验方法适用于含有非溶出性高吸水材料抑菌产品抑菌效果的测定。 注1:在进行本试验前,需要鉴定其抑菌成分是否可溶出。 注2:非溶出性抑菌材料的鉴定:将样品置于无菌蒸馏水浸泡24 h(通过预试验,吸取的浸泡液需满足后续检测要求),取浸泡液参照E.6.1抑菌剂抑菌性能试验或参照E.6.4抑菌环试验检验是否有抑菌效果。如果无抑菌效果,说明样品属非溶出性抑菌材料,进行高吸水材料抑菌性能试验。 E.6.7.2 试样制备 将10 cmX30 cm大小的食品级尼龙布(250目)用封口机做成10 cmX15 cm的尼龙布袋,作为测定吸液量备用。 测试样品选取产品的抑菌层。对照样品应与测试样品选自相同部位,同等材质、同等大小但不含抑菌成分。 E.6.7.3 吸液量的测定 取测试样品和对照样品分别剪成5.0 mmX5.0 mm的大小,各称重1.0 g±0.01 g(注意:边剪边称,称量时使用称量纸,避免高吸水材料洒出),分别放入预制的尼龙布袋中。分别将含有测试样品、对照样品的尼龙布袋以及不含样品的空尼龙布袋称重后放入肉汤培养液(NB培养基)中,浸泡30 min(注意去除气泡)后,吊起尼龙布袋20 min后分别称重。测试样品、对照样品以及空的尼龙布袋分别测定三次吸液量取平均值。吸液量测定步骤见图E.1。
吸液量计算见公式(E.13)和公式(E.14):
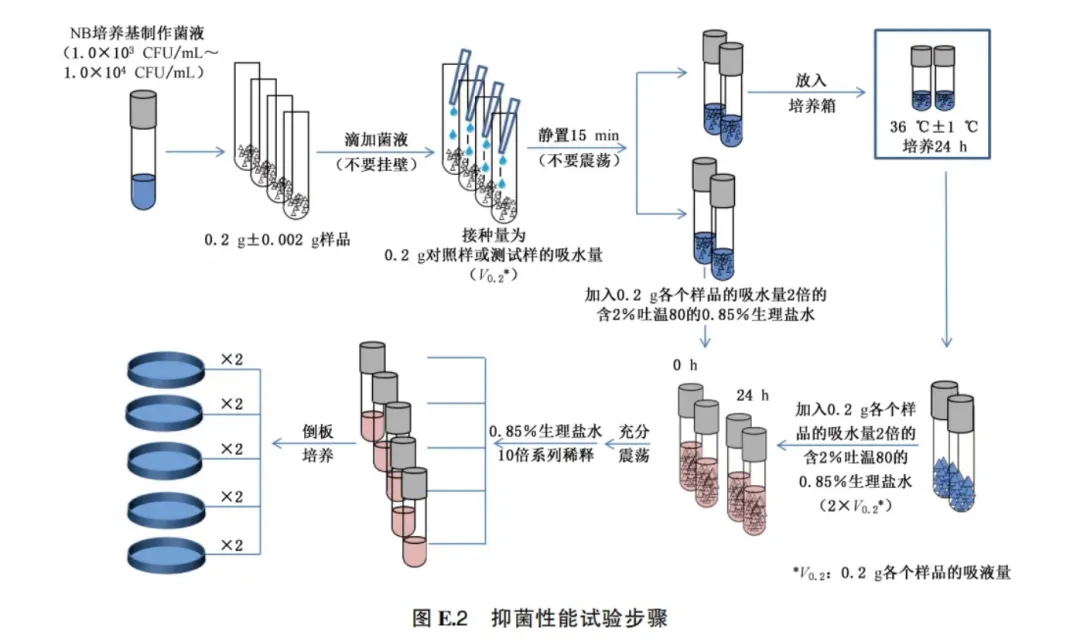
E.6.7.4 试验步骤 菌悬液制备过程:用5.0 mL肉汤洗下菌苔,使菌悬浮均匀后使用肉汤稀释至所需浓度(1.0X10³ CFU/mL~1.0X10⁴ CFU/mL)。 取测试和对照样品0.2 g±0.002 g分别放入玻璃试管中,根据E.6.7.3算出的测试和对照样品的吸液量进行换算,分别向测试及对照样品中轻轻地滴入相应的菌悬液(1.0X10³ CFU/mL~1.0X10⁴ CFU/mL)(接种菌悬液不应接触到玻璃试管壁)。静置15min让样品充分吸收菌悬液后,轻轻地盖上试管盖(请勿振荡),36℃±1℃培养24h。在培养后的对照样、测试样以及“0”培养时间的对照样和测试样中,分别加入相应吸液量2倍的含2%吐温80的0.85%生理盐水,分别充分震荡后(在振荡器上振荡5次,每次5s),进行10倍系列稀释,选择适宜稀释度,吸取1.0 mL接种平皿,每管接种2个平皿,每皿用凉至40℃~45℃的营养琼脂培养基(细菌)或沙堡弱琼脂培养基(酵母菌)15 mL~20 mL做倾注,转动平皿,使其充分混匀,琼脂凝固后翻转平皿,36℃±1 ℃培养48 h(细菌)或72 h(酵母菌),进行活菌菌落计数。试验3次,计算抑菌率。抑菌性能试验步骤见图E.2。
E.6.7.5 试验成立条件 测试样和对照样样品吸液量组内、组间误差[计算见公式(E.2)]要求均在15%以内。 对照样“0”时回收菌量不少于1.0X10³ CFU/mL~1.0X10⁴ CFU/mL,且24 h的回收菌量比“0”时增加2个对数值(lg)以上。 E.6.7.6 计算公式 抑菌率计算见式(E.15):
E.6.7.7 评价标准 各次试验抑菌率大于或等于99%判断有抑菌作用。 E.6.7.8 注意事项 吸取回收液接种培养时,如混入吸水材料可能会影响试验结果,应重新进行试验。 E.7 稳定性测试方法 E.7.1 测试条件 E.7.2 评价标准 附 录 F (规范性) 产品毒理学试验方法 —————————————————— 为人类感控事业而奋斗——明誉医疗 |